2020-04-08 京都大学
小川誠司 医学研究科教授、越智陽太郎 同特定助教、鈴木洋 マサチューセッツ工科大学客員研究員、白髭克彦 東京大学教授、宮野悟 同教授らの研究グループは、コヒーシン遺伝子変異による白血病発症の機序を解明しました。
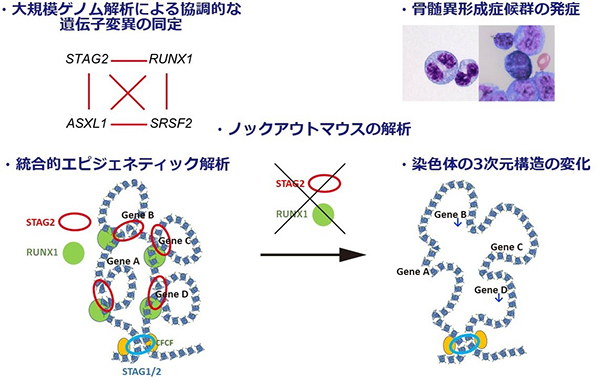
近年、本研究グループは、新規コヒーシン遺伝子変異が10-20%の白血病に認められることを報告しました。今回、本研究グループが3,000症例以上の白血病の大規模なゲノム解析、ノックアウトマウスの解析、更に次世代シーケンサーを活用した統合的エピジェネティック解析を実施した結果、(1)コヒーシンの一つであるSTAG2遺伝子変異が、RUNX1遺伝子変異と高頻度に共存すること、(2)これらの遺伝子の両方に異常が生じることで、骨髄異形成症候群を発症すること、(3)コヒーシン変異が染色体の3次元構造の変化などのエピジェネティックな異常を引き起こし、更にRUNX1変異が加わることでその異常が加速し、発がんに至ることなどを解明しました。
本研究成果は、コヒーシン変異や新規エピジェネティック異常を標的とした治療・予防法の開発に重要な手がかりを与える知見で、今後これらを標的とした新規治療薬の開発が期待されます。
本研究成果は、2020年4月6日に、国際学術誌「Cancer Discovery」のオンライン版に掲載されました。
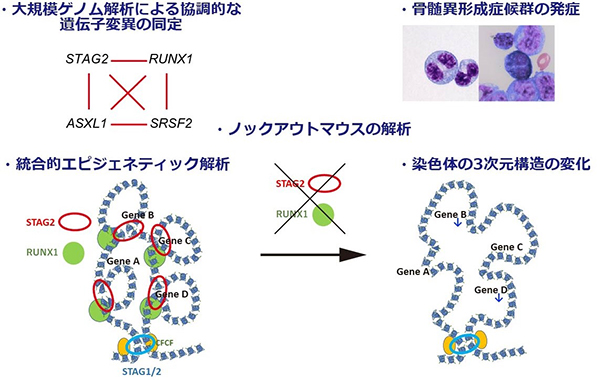
図:本研究の概要図
詳しい研究内容について
コヒーシン遺伝子変異による白血病発症の機序を解明
―染色体の 3 次元構造の異常が発がんに―
概要
急性骨髄性白血病や骨髄異形成症候群は血液のがんで、現在でも根治の難しい難治性の病気です。正常な血液細胞が遺伝子変異を獲得することで白血病を発症しますが、近年、本研究グループより新規コヒーシン遺伝子注1変異が 10-20%の白血病に認められることを報告しました。しかし、コヒーシン変異がどのように白血病を引き起こすかは、十分に分かっていません。さらに、がん細胞にしばしば複数の遺伝子変異が蓄積していることも分かってきましたが、複数の変異が発がんに関わる機序についても、不明な点が多く残されています。 今回、京都大学大学院医学研究科・腫瘍生物学講座 小川誠司 教授、越智陽太郎 同特定助教、マサチューセッツ工科大学・ コーク癌総合研究所 鈴木洋 客員研究員、東京大学定量生命科学研究所・ ノム 情報解析研究分野 白髭克彦 教授、東京大学医科学研究所附属ヒトノム 解析センター 宮野悟 教授らを中心とする研究チー は、3,000 症例以上の白血病の大規模なノム 解析、ムックアウトマウスの解析、更に次世代シーケンサーを活用した統合的エピジェネティック解析注2を実施しました。その結果、
(1) コヒーシンの一つであるSTAG2遺伝子変異が、RUNX1遺伝子変異と高頻度に共存すること、
(2) これらの遺伝子の両方に異常が生じることで、骨髄異形成症候群を発症すること、
(3) コヒーシン変異が染色体の 3 次元構造の変化などのエピジェネティックな異常を引き起こし、更に
RUNX1変異が加わることでその異常が加速し、発がんに至ること、などを解明しました。
今回の研究結果は、コヒーシン変異や新規エピジェネティック異常を標的とした治療・ 予防法の開発に重要な手がかりを与える知見で、今後これらを標的とした新規治療薬の開発が期待されます。
本研究成果は、2020 年 4 月 6 日に米国癌学会の学会誌である「Cancer Discovery」にオンライン掲載されました。
1.背景
近年の次世代シーケンサーによる大規模な遺伝子解析により、急性骨髄性白血病や骨髄異形成症候群の 1020%にコヒーシン遺伝子変異が認められることを、本研究グループは過去に報告しました。このコヒーシンは遺伝子のエピジェネティックな制御において中心的な役割を果たすことが近年次々と明らかになり、分子生物学の領域でも盛んに研究が行われるホットトピックの一つです。しかし、コヒーシンに異常が生じたときに、なぜ白血病を発症するのかは分かっていませんでした。また、コヒーシン遺伝子のうちの一つ、STAG2 遺伝子が最もよく変異を起こしますが、この STAG2変異は高頻度に他の遺伝子変異と共存することも分かってきました。しかし、複数の遺伝子変異が発がんを誘導する機序も大部分が不明なままです。
今回、コヒーシン遺伝子変異の役割を詳細に解明し、染色体の 3 次元構造という技術的に解析の難しい異常が、白血病発症に重要であろうという驚きの結果を示すことができました。更に、こうした異常は、コヒーシンのみでなく、その他の遺伝子変異が加わることで一段と悪化することも分かりました。
2.研究手法・成果
・白血病の大規模ゲノム解析により、STAG2やRUNX1遺伝子変異などの協調関係が明らかに
上記の背景から、まず遺伝子変異同士がどのような共存関係にあるかを明確にするため、3,047 例の急性骨髄性白血病や骨髄異形成症候群の症例の大規模なノム 解析を行いました。すると、一部の白血病において、エピジェネティックな制御に関わるとされるSTAG2、RUNX1、SRSF2、ASXL1の四つの遺伝子変異がきわめて高頻度に共存し、更に、これらの遺伝子変異が複数認められる場合には、著しく生存率が低く難治性であることが分かりました。このことから、これらの遺伝子変異が、白血病の進展に協調的に作用する可能性が考えられました。(図1)
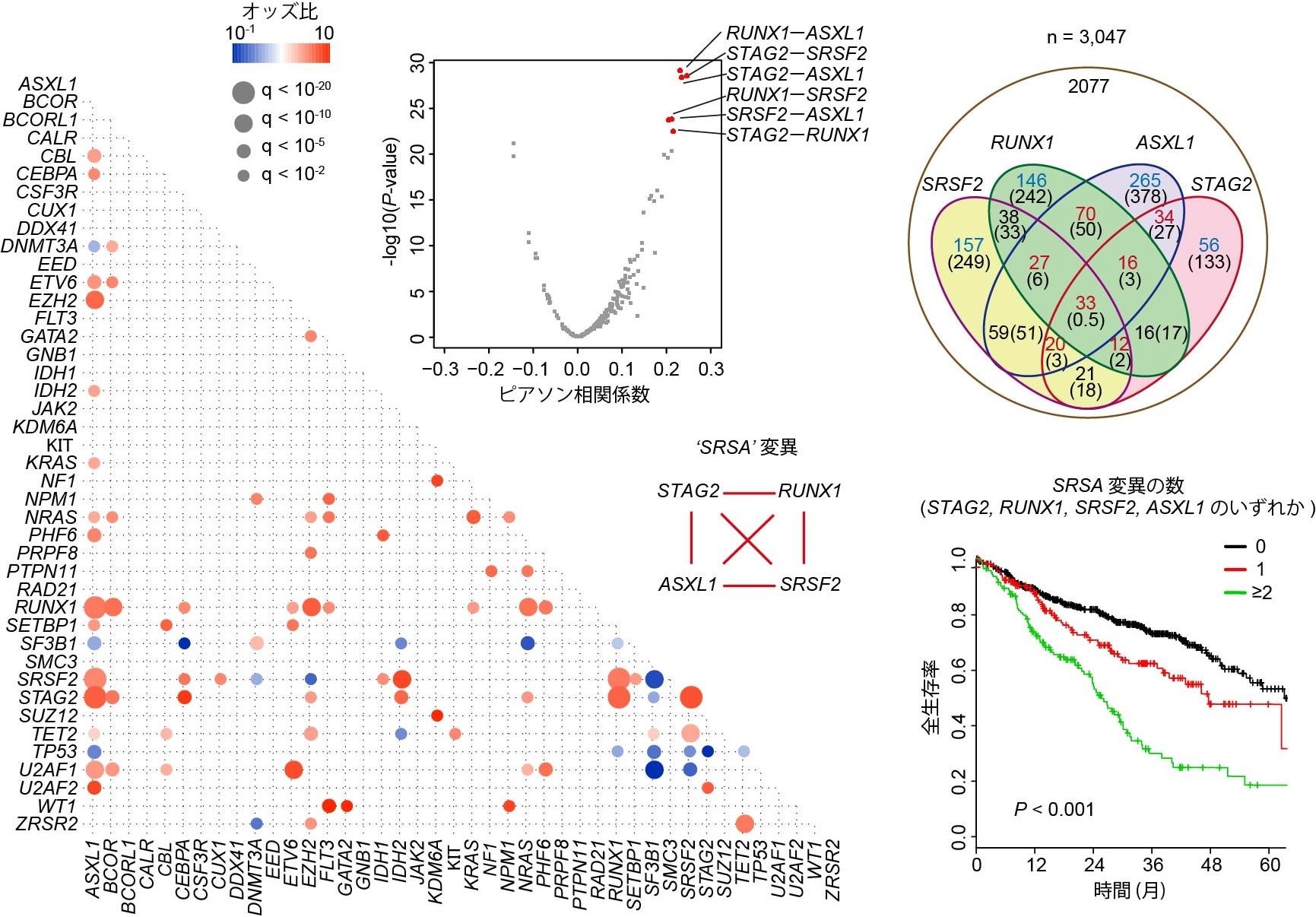
図1:白血病の大規模ノム 解析により明らかになった、STAG2やRUNX1などの四遺伝子変異の共存関係
・Stag2とRunx1両遺伝子ノックアウトマウスは骨髄異形成症候群を発症する
次に、これらの遺伝子変異を特徴とする白血病発症の分子機序を解明するため、まずは、上述のように近年同定されたコヒーシン STAG2変異に特に着目しました。Stag2ムックアウトマウスを作成したところ、様々な血液細胞の機能の異常が認められましたが、Stag2遺伝子単独の異常では白血病などのがんの発症には至りませんでした。興味深いことに、このマウスでは、造血幹細胞の機能に重要な転写因子 Runx1の活性が上昇していることが分かりました。ノム 解析での知見である STAG2と RUNX1の協調関係が改めて予想される結果となり、この2つの遺伝子間の相互機能を更に究明することとしました。
そこで、Stag2と Runx1の両遺伝子のムックアウトマウスを作成しました。予想通り、両遺伝子のムックアウトマウスは、単独の遺伝子ムックアウトマウスに比べ、一段と血液細胞の機能に異常を起こし、最終的に骨髄異形成症候群を発症しました。(図2)
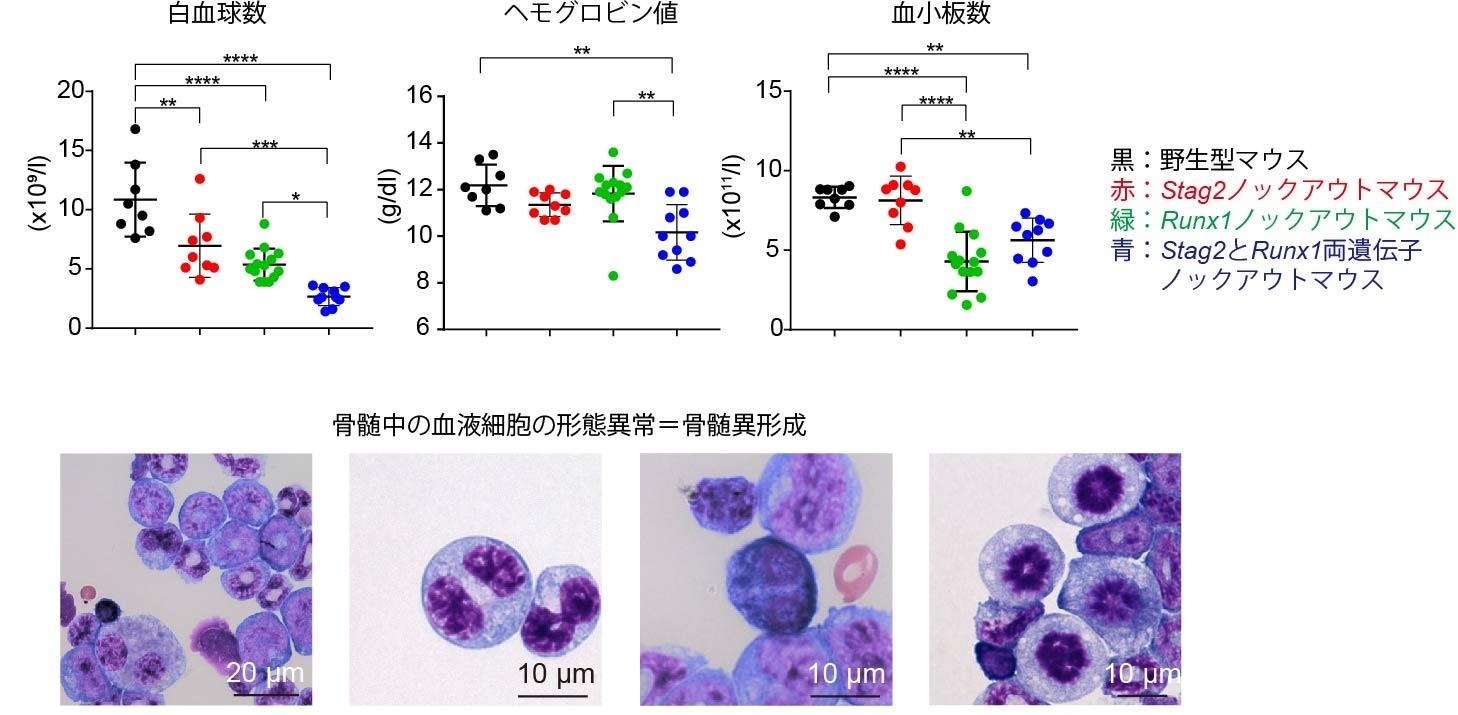
図2:Stag2/Runx1両遺伝子ムックアウトマウスは血液の異常を起こし、骨髄異形成症候群を発症する
・統合的なエピジェネティック解析で、コヒーシン変異による染色体 3 次元構造の異常が明らかに
こうしたコヒーシン STAG2 と RUNX1 の異常がどのように白血病を引き起こすかを解明するために、RNA シーケンス、ChIP シーケンス、ATAC シーケンス、Hi-C といった、次世代シーケンサーを用いた最新のエピジェネティック解析を統合的に行いました。すると、Stag2とRunx1両遺伝子のムックアウトマウスでは、非常に広範な遺伝子発現や転写因子の活性の異常が生じるほかに、染色体 3 次元構造注3において、エンハンサー・プロモーター間のループ形成注4が弱まっていることが分かりました。そして、こうしたループ形成の異常が、転写一時停止注 5 の程度の強い遺伝子の発現低下に帰結するという新規の法則性も明らかにしました。こうした遺伝子発現の異常は、コヒーシン変異のある白血病症例でも実際に認められ、更にRUNX1、SRSF2、ASXL1 などの遺伝子変異が加わることで、より顕著になることも確認されました。
このように、コヒーシン遺伝子に変異が生じると、染色体の 3 次元構造の変化などのエピジェネティックな異常が生じ、更にRUNX1などの遺伝子変異が追加されることで一段と異常が蓄積し、白血病を発症するという一連の機序を解明することができました。(図3)
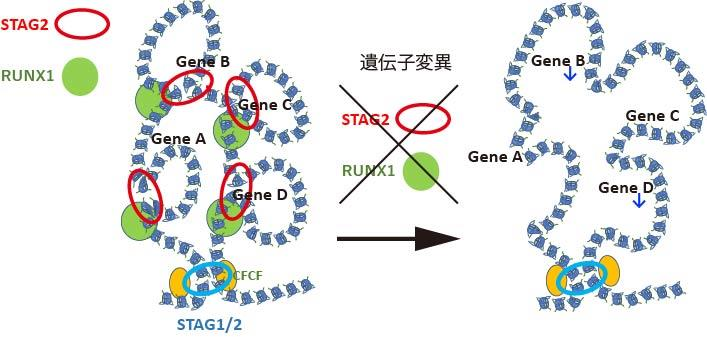
図 3:STAG2/RUNX1変異による染色体ループ破綻および特定の遺伝子発現低下の模式図
3.波及効果、今後の予定
近年のノム 解析技術の向上により、白血病を含めたがんで多数の遺伝子変異が同定されました。一方で、これらの遺伝子変異がどのように発がんにつながるか、依然として不明の点が多く残されています。今回の研究成果は、白血病の 10-20%と高頻度に認められるコヒーシン遺伝子変異の役割を詳細に解明し、染色体 3 次元構造の異常が白血病発症に重要であろうという驚きの結果となりました。更に、こうした異常は、コヒーシンのみでなくその他の特定の遺伝子変異が加わることで一段と悪化することも分かりました。そのため、今後は遺伝子変異による染色体 3 次元構造の変化や、複数遺伝子変異による協調作用などを、より幅広く解析することが重要となっていくものと考えられます。また、本研究で新たに分かったコヒーシンの機能に関しては、分子生物学領域における基礎研究の進展にも重要な手がかりを与えるものと期待されます。
近年はエピジェネティックな異常を標的とした新規薬剤も多数登場しています。本研究で解明された染色体3 次元構造の異常などの一連の機序を手がかりとして、新しい治療・予防法を求めて研究を行っていきます。
4.研究プロジェクトについて
本研究プロジェクトは、下記の補助金による支援を受けて行われました。
●科学研究費補助金・新学術領域研究
●科学研究費補助金・基盤研究(S)
●日本医療研究開発機構研究費・次世代がん医療創生研究事業
●日本医療研究開発機構研究費・革新的先端研究開発支援事業
●文部科学省ポスト「 京」で重点的に取り組むべき社会的・ 科学的課題に関するアプリケーション開発・研究開発
<用語解説>
注1 コヒーシン遺伝子:SMC1, SMC3, RAD21, STAG1/2 の 4 つのタンパク質で構成される複合体で、リング状の構造をとり、細胞分裂や DNA 損傷の修復、更には遺伝子発現の調節など、多彩な機能をもつことが知られています。コヒーシン遺伝子は、これら 4 つのタンパク質のいずれかをコードする遺伝子を指します。
注2 エピジェネティック解析:エピジェネティクスとは、細胞の遺伝情報(DNA)の塩基配列の変化を伴わない情報記憶と遺伝子発現調節のメカニズ です。エピジェネティクスを担う機構として、DNA メチル化やヒストン修飾、染色体の 3 次元構造などがあります。本研究のエピジェネティック解析では、次世代シーケンサーを駆使し、このエピジェネティクスの状態を網羅的に評価しました。
注3 染色体の 3 次元構造:DNA は細胞の核内で空間的に小さく折りたたまれた構造(染色体)を形成して存在しています。この折りたたまれた染色体の 3 次元構造が、例えば遺伝子発現の調節など、細胞の様々な機能に重要な役割を果たしているとされています。
注4 エンハンサー・プロモーター間のループ:遺伝子の発現は、プロモーターとよばれる領域の近くから、RNA ポリメラーゼが RNA の合成(転写)を開始する事で行われます。エンハンサーは、遺伝子プロモーターに働きかけ、遺伝子の転写・ 発現を促進させますが、ノム 上ではしばしばプロモーターと離れた位置に存在します。ここで、上記のような染色体の 3 次元構造により、エンハンサーとプロモーターが空間的に近接しループ構造をとることで、エンハンサーが遺伝子の発現を調節することが近年分かってきています。
注 5 転写一時停止:RNA ポリメラーゼが転写を行う際に、RNA ポリメラーゼはプロモーターの近傍で一時停止し、その後に RNA を伸長させていきます。この転写の一時停止が、遺伝子の発現の制御に重要な役割を果たすとされています。
<研究者のコメント>
今回、白血病の大規模ノム 解析、ムックアウトマウスの解析、更には統合的なエピジェネティック解析と、多数の研究領域にまたがる徹底した解析を行いました。すると、白血病発症に、染色体の 3 次元構造の異常が重要な役割を果たしているかもしれないという、驚きの結果にたどり着くことができました。更に、複数の遺伝子変異が協調し、こうしたエピジェネティックな異常を悪化させ、がんの発症・ 進展に至るという機序の一端を解明することができました。今回の研究成果を手がかりとして、更なる白血病の発症機序の解明、新規治療法の開発に取り組んでいきます。私たちの研究が、白血病を含むがんの予防や治療の発展に貢献できればと考えています。(京都大学医学研究科 腫瘍生物学講座・教授 小川 誠司、同特定助教 越智 陽太郎)
<論文タイトルと著者>
タイトル:Combined Cohesin-Runx1 Deficiency Synergistically Perturbs Chromatin Looping and Causes Myelodysplastic Syndromes
(コヒーシンおよび RUNX1 欠失によるクロマチンループ破綻および骨髄異形成症候群発症)
著 者:Yotaro Ochi1,2, Ayana Kon1, Toyonori Sakata3, Masahiro M Nakagawa1, Naotaka Nakazawa4, Masanori Kakuta5, Keisuke Kataoka1, Haruhiko Koseki6, Manabu Nakayama7, Daisuke Morishita8, Tatsuaki Tsuruyama9, Ryunosuke Saiki1, Akinori Yoda1, Rurika Okuda1, Tetsuichi
Yoshizato1, Kenichi Yoshida1, Yusuke Shiozawa1, Yasuhito Nannya1, Shinichi Kotani1,2, Yasunori Kogure1, Nobuyuki Kakiuchi1, Tomomi Nishimura1, Hideki Makishima1, Luca Malcovati10,11, Akihiko Yokoyama12, Kengo Takeuchi13, Eiji Sugihara14, Taka-aki Sato14, Masashi Sanada15, Akifumi Takaori-Kondo2, Mario Cazzola10,11, Mineko Kengaku4,16, Satoru Miyano5, Katsuhiko
Shirahige3, Hiroshi I Suzuki17*, and Seishi Ogawa1,18,19*
所属機関:1Department of Pathology and Tumor Biology, Graduate School of Medicine, Kyoto University, Kyoto, Japan, 2Department of Hematology and Oncology, Graduate School of Medicine, Kyoto University, Kyoto, Japan, 3Laboratory of Genome Structure and Function, Research Division for
Quantitative Life Sciences, Institute for Quantitative Biosciences, The University of Tokyo, Tokyo, Japan, 4Institute for Integrated Cell-Material Sciences (WPI-iCeMS), Kyoto University, Kyoto, Japan, 5Laboratory of DNA Information Analysis, Human Genome Center, Institute of Medical Science, The University of Tokyo, Tokyo, Japan, 6Laboratory for Developmental
Genetics, RIKEN Center for Integrative Medical Sciences, Yokohama, Japan, 7Laboratory of Medical Omics Research, Department of Frontier Research and Development, Kazusa DNA Research Institute, Kisarazu, Japan, 8Chordia Therapeutics Inc., Kanagawa, Japan, 9Department of Drug and Discovery Medicine, Pathology Division, Graduate School of Medicine, Kyoto University, Kyoto, Japan, 10Department of Molecular Medicine, University of Pavia, Pavia, Italy, 11Department of Hematology Oncology, Fondazione IRCCS Policlinico San Matteo, Pavia, Italy, 12Tsuruoka Metabolomics Laboratory, National Cancer Center, Yamagata, Japan, 13Pathology Project for Molecular Targets, Cancer Institute, Japanese Foundation for Cancer Research, Tokyo, Japan, 14Research and Development Center for Precision Medicine, University of Tsukuba, Ibaraki, Japan, 15Department of Advanced Diagnosis, Clinical Research Center, National Hospital Organization Nagoya Medical Center, Nagoya, Japan, 16Graduate School of Biostudies, Kyoto University, Kyoto, Japan, 17David H. Koch Institute for Integrative Cancer Research, Massachusetts Institute of Technology, Cambridge, MA, USA, 18Institute for the Advanced Study of Human Biology (WPI-ASHBi), Kyoto University, Kyoto, Japan, 19Department of Medicine, Centre for Haematology and Regenerative Medicine, Karolinska Institute, Stockholm, Sweden
掲 載 誌:Cancer Discovery DOI:未定