2020-01-31 理化学研究所,東京工業大学,科学技術振興機構
ポイント
理化学研究所(理研) 生命機能科学研究センター 細胞構造生物学研究チームの葛西 卓磨 研究員(JST さきがけ研究者)、木川 隆則 チームリーダー(東京工業大学 情報理工学院 特定教授)、東京工業大学 情報理工学院 情報工学系の小野 峻佑 准教授(JST さきがけ研究者)らの共同研究グループは、核磁気共鳴(NMR)法注1)に情報・数理科学の手法を応用することで、従来は解析が困難だった重なり合うNMR信号注1)を分離し、たんぱく質の構造や動きなどに関する情報を得る新たな方法「SiPex(Stable-isotope-assisted Parameter extraction)法」を開発しました。
本研究成果は、たんぱく質の機能に関する基礎研究に貢献し、たんぱく質と医薬品候補分子の結合状態の解析に基づく創薬研究を加速させると期待できます。
NMR法は、強い磁場中に置かれた原子核から発せられる信号(NMR信号)を観測し、分子の構造を解析する手法です。たんぱく質の解析では、NMR法で観測可能な安定同位体注2)で標識した試料を用いることが標準的です。
今回共同研究グループは、先行研究で開発した「符号化標識法注3)」と数理科学の応用により、重なり合う複数のNMR信号からでも、アミノ酸の情報とたんぱく質の性質の情報を取得することに成功しました。
本研究は、科学雑誌「Journal of Biomolecular NMR」のオンライン版(2020年1月30日付)に掲載されました。
本研究の一部は、JST 戦略的創造研究推進事業 さきがけ「計測技術と高度情報処理の融合によるインテリジェント計測・解析手法の開発と応用(研究総括:雨宮 慶幸、副研究総括:北川 源四郎)」の研究課題「試料への情報の符号化を活用するNMR計測・解析法(研究者:葛西 卓磨)」および「統合的凸最適化によるIn Handな成分分離型信号情報再構成(研究者:小野 峻佑)」、戦略的創造研究推進事業 CREST「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」の研究課題「NMRと計算科学の融合によるin situ構造生物学の確立と真核細胞内蛋白質の動態研究への応用」による支援を受けて行われました。
<背景>
アミノ酸が連なってできたたんぱく質は、その構造と動きによって分子機能が決まります。そのため、たんぱく質の構造や動きの解析は、その機能を解明する上で重要です。核磁気共鳴(NMR)法は、強い磁場中に置かれた原子核に電磁波を照射すると、原子の置かれた状況によって特徴的な信号(NMR信号)が観測される物理現象(核磁気共鳴)を応用した、分子構造などの解析法です。生体環境に近い溶液中でたんぱく質分子に含まれる原子を直接観測できるという特長から、たんぱく質の構造、機能、動き、作用機序の解明に欠かせません。
NMR法でたんぱく質の解析を行うには、まず、複数の原子から発せられるそれぞれのNMR信号が、どの原子に由来するかを決める「信号帰属」を行います。たんぱく質の解析では、炭素13(13C)や窒素15(15N)の安定同位体でアミノ酸を標識し、信号帰属を効率良く行うことが標準的な方法となっています。
測定されたNMR信号は2次元平面上のスペクトル注4)で表すことができますが、複数の信号が同じ位置に重なると、信号帰属が困難になります。NMR信号の重なりは、異なる位置の原子に由来する信号が分離しにくい天然変性たんぱく質注5)、信号の数が多い高分子量たんぱく質、一つ一つの信号の広がりが大きくなってしまう生細胞内のたんぱく質などで著しく生じ、たんぱく質の一部の構造や動きについての情報しか得られず、解析は不完全なものになってしまいます。
信号が重なった場合にも信号帰属を補助する情報を提供し、重なった信号を分離しつつ、たんぱく質の性質を解析する方法があれば、これまで解析が困難であったたんぱく質の部位をもNMR法によって解析することができます。また、解析は可能であっても信号帰属に時間がかかっていたたんぱく質を、迅速に解析できるようになることも期待されます。
<研究手法と成果>
葛西 卓磨 研究員らは、2015年に「符号化標識法」を開発しました※)。NMR解析における安定同位体標識の標準的な方法では、たんぱく質中の安定同位体の有無の情報だけを利用するのに対し、符号化標識法では、アミノ酸の情報をたんぱく質に「符号化」し、アミノ酸ごとに異なる安定同位体標識パターン(符号語)を割り当てたたんぱく質試料を用います。一例としては、15Nでの3つの標識率(100パーセント、75パーセント、50パーセント)と、13Cでの3つの標識率(100パーセント、50パーセント、0パーセント)の組み合わせでアミノ酸を標識したたんぱく質(標識体)を3パターン用意し、それぞれをNMRで計測します。これにより、観測されたNMRスペクトルから、アミノ酸の情報を「復号」して取り出せるようにしておきます(図1)。
本研究で開発した「SiPex法」は、符号化標識法を応用したもので、この標識パターンを単にアミノ酸の情報を取り出すだけではなく、重なった信号を分離する手掛かりとしても用います。まず、符号化標識したたんぱく質試料を用いて、アミノ酸の情報を得るための測定と、15N緩和速度注6)などたんぱく質の性質を得るための測定を行い、これらを組み合わせて解析します。測定ごとに得られるNMRスペクトルは2次元ですが、それらを集めて、全体では4次元のテンソル注7)であると見なし、テンソル分解注7)という数理解析手法で信号ごとに分離します。分離された各成分の3次元目のシグナル強度にはアミノ酸の情報が含まれており、符号語表と照らし合わせて解析することで、アミノ酸の情報を復号することができます。また、各成分の4次元目の強度は、15N緩和速度の情報を持っており、たんぱく質の動きの情報を取り出すことができます。このように、たんぱく質のNMR解析において障害となっていた信号の重なりの問題を解決しつつ、信号帰属の助けとなるアミノ酸情報と、たんぱく質の動きなど性質に関する情報を同時に取り出すことができるのが、SiPex法の特長です(図2)。
共同研究グループは、SiPex法の性能を評価するため、ユビキチンと呼ばれるたんぱく質をモデルにした実証実験を行いました。従来のNMR法によるたんぱく質の測定では、15~16番目のLE(ロイシン-グルタミン酸)というアミノ酸の並びと、25~26番目のNV(アスパラギン-バリン)というアミノ酸の並びに対応するシグナルが重なってしまうことが分かっています。SiPex法による解析でも、重なったシグナルが確かに2つの成分で構成されていることが分かり、それぞれの成分から正しいアミノ酸情報を取り出し、かつ、15N緩和速度の情報を取り出すことができました(図3)。このことは、従来の技術では解析が困難であったたんぱく質に対して、SiPex法が有効であることを示しています。
※)Kasai T, Koshiba S, Yokoyama J, Kigawa T (2015), Stable isotope labeling strategy based on coding theory. J Biomol NMR, 63:213-221
<今後の期待>
SiPex法は、NMRを用いて信号の分離を行いながらたんぱく質の情報を取得する新しい手法であり、たんぱく質の構造、動き、他の分子との結合などの解析に用いることができます。符号化、復号という情報科学の手法と、テンソル分解という数理科学の手法を組み合わせて用いることで、たんぱく質のNMR解析という生命科学の手法を革新したもので、異分野の研究者の共同研究によって実現されました。
SiPex法を用いることで、従来のNMR法では信号が重なることでたんぱく質の性質に関する情報が得られなかったたんぱく質の解析が可能になるだけでなく、SiPex法で得られるアミノ酸の情報は信号帰属にも有用なため、信号帰属が困難であったたんぱく質の解析も可能になります。特に、天然変性たんぱく質の解析や、生きている細胞内のたんぱく質を直接観測し、解析するin-cell NMR法注8)などにおいて、解析可能なたんぱく質の種類を増やすことにつながり、たんぱく質の機能や作用機構の解明という基礎研究に役立ちます。また、信号帰属に役立つアミノ酸の情報と、たんぱく質の性質に関する情報がリンクした形で得られるため、従来のNMR法で解析可能であったたんぱく質についても、より迅速、効率的に解析することができます。生命科学における基礎研究の加速はもちろんのこと、医薬品候補分子との結合を迅速に評価し改善につなげる必要がある創薬研究など応用研究にも役立つと期待できます。
<参考図>
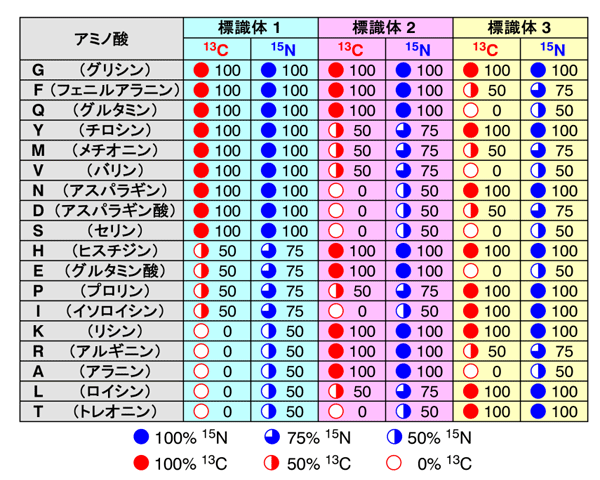
図1 符号化標識法における安定同位体標識パターン(符号語表)の例
アミノ酸ごとに異なる安定同位体標識パターンを対応させる「符号語表」に従い、3パターンのたんぱく質試料(標識体)を用意する。ユビキチンたんぱく質に含まれる18種類のアミノ酸を判別可能な符号語表の一例を示す。アミノ酸の情報を「復号」するには、標識体ごとにNMR計測を行い、同位体の比率に伴うNMR信号の強度の違いを利用する。例えば標識体1では、15Nの標識率が100パーセントであるアミノ酸は9種類まで絞られる。さらに、標識体2と標識体3の情報を合わせると、全ての標識体において15Nの標識率が100パーセントの強度として観測されるNMR信号は、G(グリシン)に由来すると判断できる。
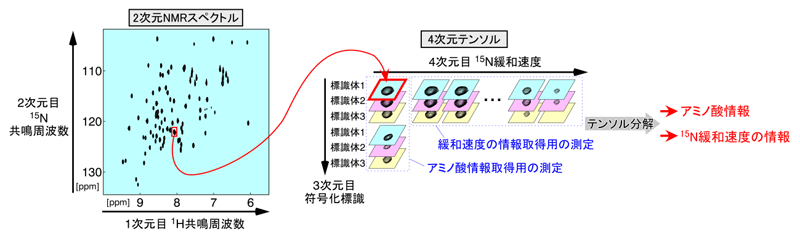
図2 符号化標識法で得られたスペクトルを用いた、信号の分離と情報の取り出し
左図は、特定のアミノ酸に由来するNMR信号の分布(スペクトル)を、横軸を1H共鳴周波数、縦軸を15N共鳴周波数として表したもの。赤四角で囲んだ点は、2つのNMR信号が同じ位置で重なったものだが、テンソル分解により2つのアミノ酸情報に分離することができる。さらに、テンソル分解を利用して15N緩和速度を測定することで、たんぱく質の動きの情報が得られる。
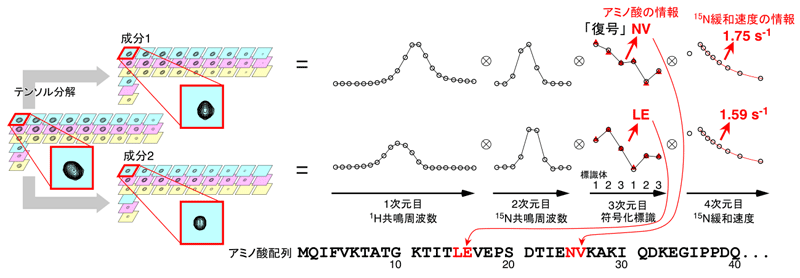
図3 SiPexによるユビキチンたんぱく質の重なった信号の分離と情報の取り出し
84個のアミノ酸から成るユビキチンの変異たんぱく質を用いたSiPex法の実証実験。重なり合った信号が、テンソル分解により2つの成分に分けられた。各成分に含まれるアミノ酸情報を取り出すと、成分1に対応するのは25~26番目のNV(アスパラギン-バリン)であり、成分2に対応するのは15~16番目のLE(ロイシン-グルタミン酸)であることが分かった。また、15N緩和速度の情報を取り出すと、どちらも同じくらい動き(揺らぎ)のある領域であることが読み取れた。
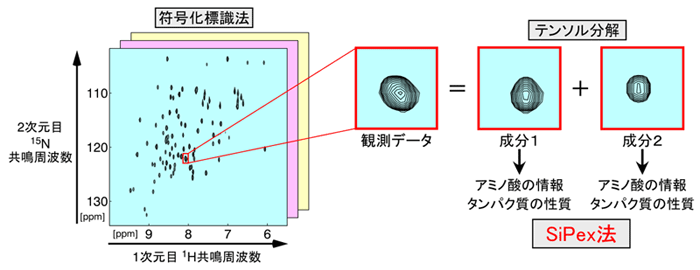
図 情報科学(符号化標識法)と数理科学(テンソル分解)を応用したSiPex法
<用語解説>
- 注1)核磁気共鳴(NMR)法、NMR信号
- 強い磁場中に置かれた原子核に電磁波を照射すると、核スピンの共鳴現象により、原子核の性質や周囲の環境に応じた周波数(共鳴周波数)の電磁波の吸収や放出が起こるが、その電磁波をNMR信号として捉えることで、物質の分子構造の解析や物性の解析を行う手法。分子の相互作用などの情報も得られるため、生命科学、医薬、化学、食品、材料物性といった幅広い分野で利用されている。NMRはNuclear Magnetic Resonanceの略。
- 注2)安定同位体
- 原子番号が同じで質量の異なる同位体のうち、放射性崩壊を起こさず安定に存在するもの。たんぱく質の主要な構成元素は水素、炭素、窒素であるが、それぞれ自然界では水素1(1H)、炭素12(12C)、窒素14(14N)がほとんどを占めている。このうち、1HはNMR法で観測可能だが、12C、14Nは観測不能か困難である。そのため、物理化学的性質がほとんど変わらない安定同位体でありNMR観測が可能な13C、15Nに置き換えたたんぱく質試料を用いることが標準的な方法となっている。安定同位体に置き換えることでNMR観測が可能になることから、興味のある原子を観測するための標識としても利用できる。
- 注3)符号化標識法
- 葛西 卓磨 研究員らが2015年に発表したたんぱく質の標識方法。少ない種類の標識体で20種類全てのアミノ酸を判別することを目指した。SiCode(Stable isotope encoding)法ともいう。
- 注4)スペクトル
- 各周波数において、どれくらいの強度の信号が観測されたかを表すデータ。NMR法はラジオ波の周波数領域の電磁波を扱う分光法の一種であり、NMR信号を共鳴周波数ごとに分解したスペクトルで表すことができる。
- 注5)天然変性たんぱく質
- 溶液中での構造変化が大きく、たんぱく質の一部、もしくは全体にわたって一定の構造をとらないたんぱく質。従来の構造生物学では解析の対象になりにくかったが、近年では機能との関連が注目されている。
- 注6)15N緩和速度
- たんぱく質分子に含まれるアミド(-NH)基の窒素NMR信号の減衰の速さ(15N緩和速度)は、たんぱく質の動きの大きさや速さを反映することが知られている。15N標識したたんぱく質試料を用い、2次元NMRスペクトル上の各信号の減衰を測定する。たんぱく質を構成するアミノ酸のほとんどにアミド基が含まれることから、たんぱく質分子中のさまざまな箇所の動きを解析できる。
- 注7)テンソル、テンソル分解
- テンソルは、本研究においては数値を3次元以上に並べたもの。1個の数値(0次元)はスカラー、数値を1列(1次元)に並べたものはベクトル、数値を2次元に並べたものは行列と呼ばれる。テンソル分解(テンソル因子分解ともいう)は、テンソルをより単純な形で表すこと。本研究においては、テンソルをベクトルの直積の和というより単純な形で表す方法(polyadic decomposition)によってテンソル分解をしている。
- 注8)in-cell NMR法
- 水溶液中のたんぱく質をNMR測定する通常の方法に対して、生きた細胞内に導入したたんぱく質を測定する方法。細胞内はたんぱく質や核酸などの生体分子が高濃度で存在する「分子混雑」の状態で、水溶液中とは異なった環境である。in-cell NMRは実際に機能している環境下のたんぱく質の解析が可能な方法として注目されている。
<論文タイトル>
- “Amino-acid selective isotope labeling enables simultaneous overlapping signal decomposition and information extraction from NMR spectra”
- DOI:10.1007/s10858-019-00295-9
<お問い合わせ先>
<研究に関すること>
葛西 卓磨(カサイ タクマ)
理化学研究所 生命機能科学研究センター 細胞構造生物学研究チーム 研究員
木川 隆則(キガワ タカノリ)
理化学研究所 生命機能科学研究センター 細胞構造生物学研究チーム チームリーダー
小野 峻佑(オノ シュンスケ)
東京工業大学 情報理工学院 情報工学系 准教授
<JST事業に関すること>
中村 幹(ナカムラ ツヨシ)
科学技術振興機構 戦略研究推進部 グリーンイノベーショングループ
<報道担当>
理化学研究所 生命機能科学研究センター センター長室 報道担当(山岸)
理化学研究所 広報室 報道担当
東京工業大学 広報・社会連携本部 広報・地域連携部門
科学技術振興機構 広報課