2021-12-09 生理学研究所
内容
細胞膜上には、特定のイオンだけを選択的に透過する種々のイオンチャネルがあり、イオンチャネルの変異は様々な疾患を引き起こします。イオンチャネルの中央部分にはイオンを選択的に通すための穴である透過路が一つありますが、イオン選択性の異常は、この透過路がゆがむことによって引き起こされると想定されてきました。しかし、それを実証する研究はなく、その詳細は知られていませんでした。今回、自然科学研究機構生理学研究所の陳以珊特任助教(研究実施当時)(現 和歌山県立医科大学医学部薬理学講座 講師)、久保義弘教授、University of British Columbia, Vancouver(カナダ)のJodene Eldstrom研究員、David Fedida教授の国際共同研究グループは、K+チャネルの一種であるGIRK2の遺伝性変異におけるイオン選択性の異常のメカニズムを検証しました。その結果、これまで知られてきたチャネルタンパク質分子中央のイオン透過路だけでなく、第二のイオン透過路が新たに形成され、正常体では透過しないイオンが通過していることがイオン選択性異常の原因であることを明らかにしました(図1)。今回の研究成果は、第二の透過路を阻害すればイオン選択性の異常を是正できる可能性を示しており、新規治療薬の開発につながる成果だと期待できます。本研究結果は、The Journal of Physiology誌(日本時間2021年12月9日午前10時解禁)にオンライン出版されました。
細胞膜上には、イオンの通り道(穴)を中央に持つ膜タンパク質であるイオンチャネルが存在します。イオンチャネルは体内で非常に重要な働きをしており、例えば、K+ を選択的に通すイオンチャネルの一種であるGタンパク質結合型内向き整流性K+チャネルGIRKは、脳の神経細胞の活動、心拍やホルモン分泌の調節等において重要な役割を果たしています。
イオンチャネルが特定のイオンだけを選択性に透過することが出来るのは、チャネル分子中央のイオンの通る穴にあるイオン選択性フィルタ(SF)によって、イオンの選別が行われるからです(図2)。しかし遺伝子変異などによりイオン選択性フィルタ部位のアミノ酸残基が変異すると、イオンが正しく選別されず、様々な疾患を引き起こします。実際に、GIRKチャネルの遺伝子変異は、発達遅滞、知的障害、小頭症、老化風貌等を主徴とする遺伝性疾患であるKeppen-Lubinsky 症候群や原発性アルドステロン症を引き起こすことが報告されています。これまで、イオン選択性の異常は、イオン選択性フィルタのゆがみ、ゆるみによるものと想定されてきましたが、その仮説を実証する研究はなく、詳細は不明でした。そこで、本研究ではイオン選択性の異常の原因を解明するため、実験を行いました。
通常、GIRK2チャネルはイオン選択性フィルタ透過路からK+イオンのみを通しますが、イオン選択性フィルタ近辺のアミノ酸残基を変異させた変異体(Gly156Ser)では、K+イオンだけでなく、Na+も透過することが分かっていました。研究グループは、この変異体(Gly156Ser)においてNa+やLi+がどのように流入しているのかを確かめるため、イオン選択性フィルタを阻害するBa2+やTPN-Qを投与することで、イオンの通り道を塞ぐ実験を行いました。その結果、K+の流入は減ったものの、意外にもNa+やLi+の流入はあまり減っておらず、K+に対する相対的なイオン透過が劇的に上昇することが観察されました。この結果は、Na+やLi+はイオン選択性フィルタを通って流入しているのではなく、別の通り道から流入していることを示唆しています。つまり「K+をよく透過し、Ba2+やTPN-Qにより阻害されるイオン選択性フィルタ透過路」に加えて、「Na+やLi+をよく透過する、イオン選択性フィルタ透過路以外の第二のイオン透過路」が変異により新たに形成されていると考えられます(図3)。
実際に、パッチクランプ法を用いて、単一GIRK2チャネルが透過するそれぞれのイオンの電流を測定したところ、K+電流はTPN-Qにより阻害される一方で、Li+電流はTPN-Qを投与しても阻害されにくいことが分かりました。また、K+とLi+両方を細胞外において記録すると、2種の異なるチャネル活動が記録され、K+に相当すると考えられる電流のみがTPN-Qにより阻害されることが観察されました(図4)。これらの結果から、イオン選択性フィルタ透過路とは別の、第二のイオン透過路が変異により形成されていることが明らかになりました。また、この第二のイオン透過路はイオン選択性フィルタ(SF)とポアヘリックス(PH)の間に形成されていると考えられます(図1)。今回の結果は、「イオン選択性の異常は、イオン選択性フィルタのゆがみ、ゆるみによるもの」とされていた、これまでの考えを覆すものです。
陳以珊氏は「今回の研究で、GIRK2チャネルの変異による重篤な遺伝性疾患における、異常なイオン選択性の病態メカニズムがわかりました。新たに発見した第二のイオン透過路を阻害すれば、異常なイオン流入が是正できる可能性があり、新規治療薬の開発につながる成果だと期待できます。」と話しています。
本研究は文部科学省科学研究費補助金、上原記念生命科学財団の補助を受けて行われました。
今回の発見
- GIRK2チャネルのイオン選択性フィルタ(SF)部分が変異したGly156Ser変異体では、通常のSFの構成するK+ の透過路とは別に、Na+ やLi+ が通過する第二のイオン透過路が新たに形成されたことがわかりました。
- Na+ やLi+ が通過する第二の透過路は、SFとその背後に位置するポアヘリックス(PH)の間の空間に位置することが示唆されました。
図1 遺伝性疾患を引き起こすアミノ酸変異による第二のイオン透過路の形成
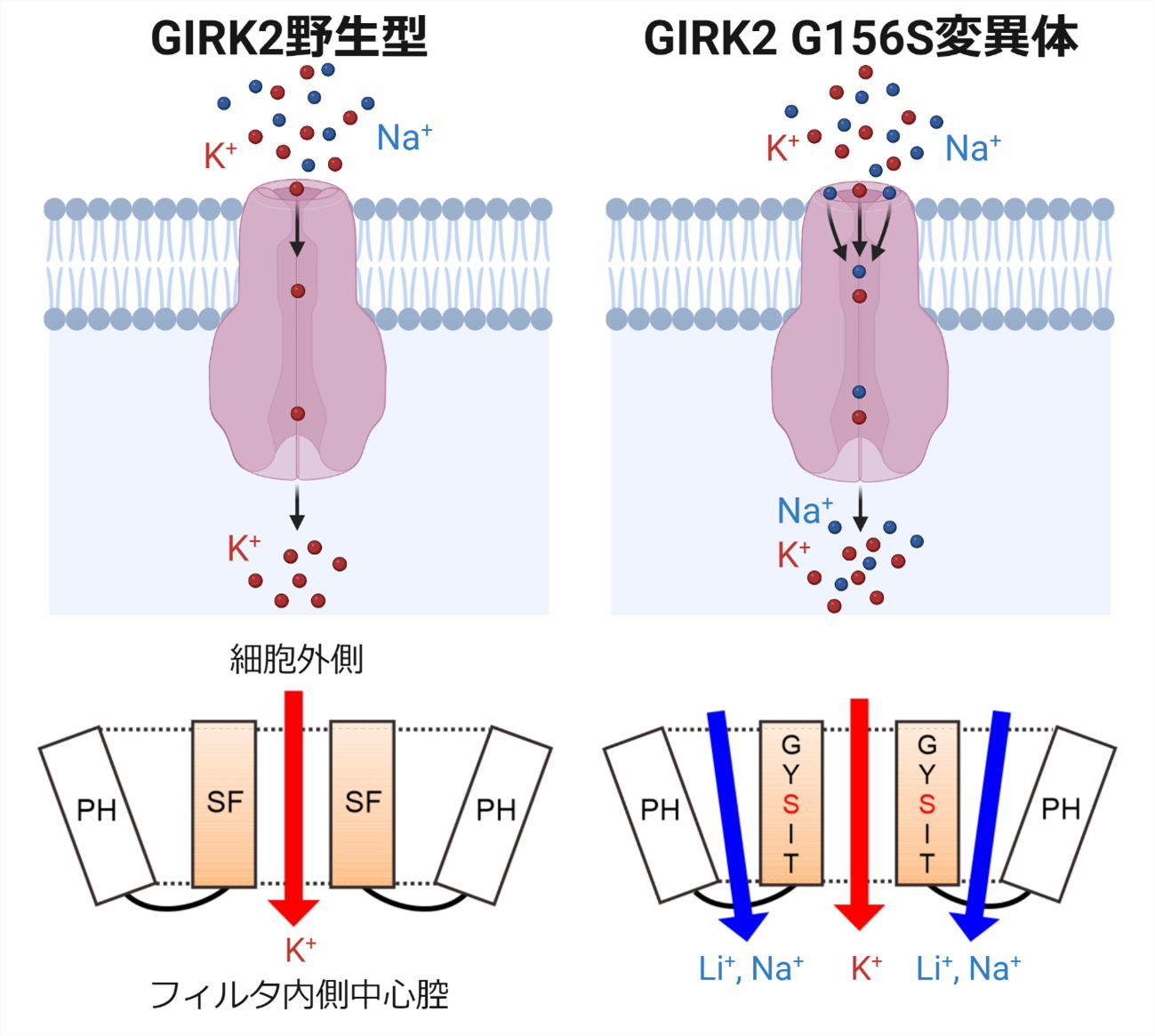
正常なGIRK2チャネル(野生型)においては、イオン選択性フィルタ(SF)の働きにより、K+が選択的に透過し、Na+はほとんど透過しません。遺伝性疾患を引き起こすことが知られている156番目のアミノ酸残基GlyをSerに置換したGly156Ser変異体 (G156S) では、SF透過路とは別に、SFとポアヘリックス(PH)の間に、Na+ や Li+ を透過する第二のイオン透過路が新たに形成されることが明らかになりました。
図2 GIRK2チャネルのイオン選択性フィルタ(SF) の構造と、その変異による遺伝性疾患
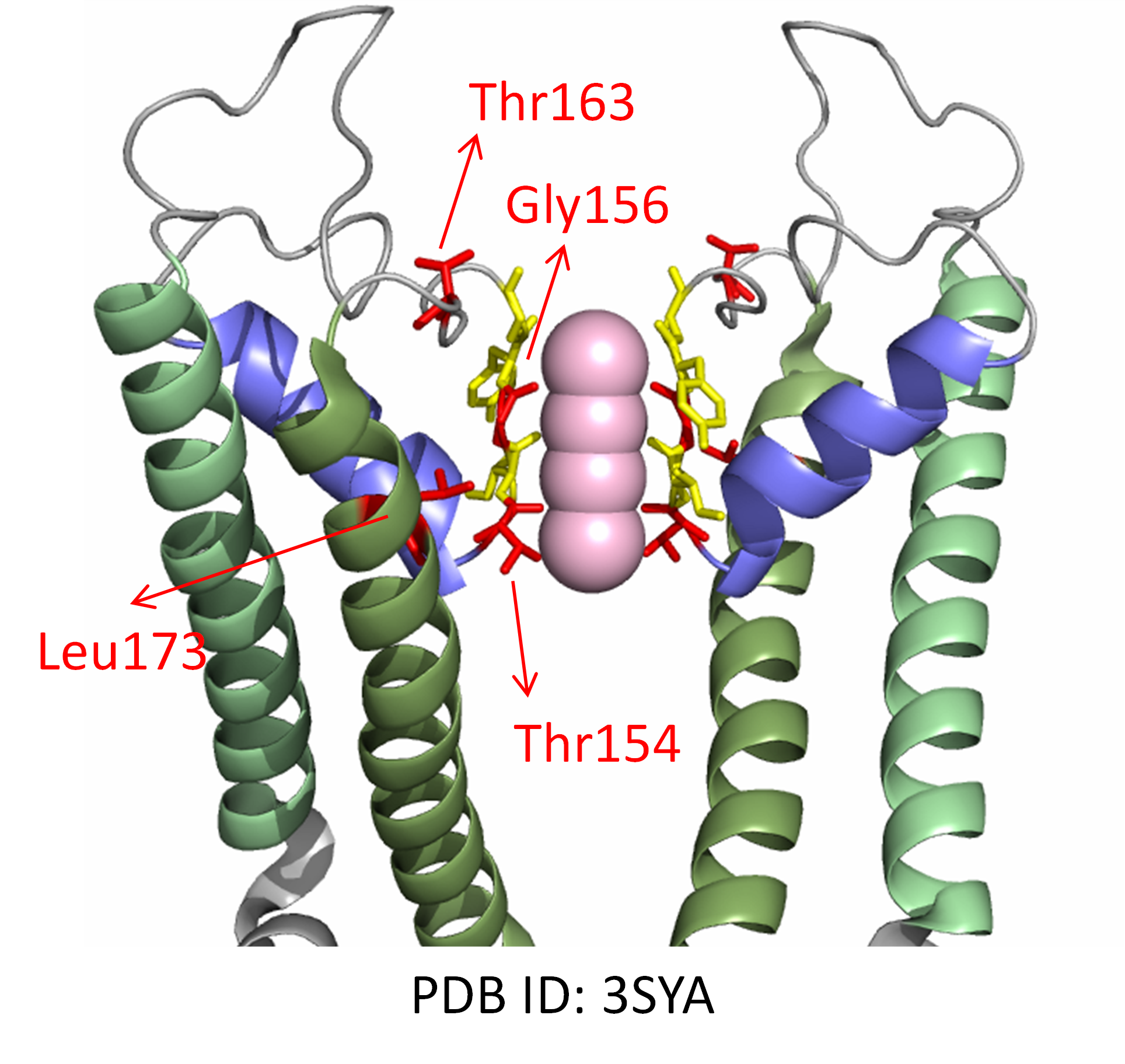
マウスGIRK2チャネルのイオン透過路の立体構造(PDF ID: 3SYA)を示します。K+(ピンクの玉)は、イオン選択性フィルタ(SF)(黄色)によって選別され、選択的にチャネルを透過することが出来ます。変異により、イオン選択性の異常による遺伝性疾患が引き起こされることが知られているSFのアミノ酸残基を赤で示しています。SFは、背後からポアヘリックス(PH)(青色)で支えられています。
図3 GIRK2チャネル変異体 Gly156Serの示す異常なイオン透過と、イオン透過路の阻害剤の投与によるイオン選択性の変化
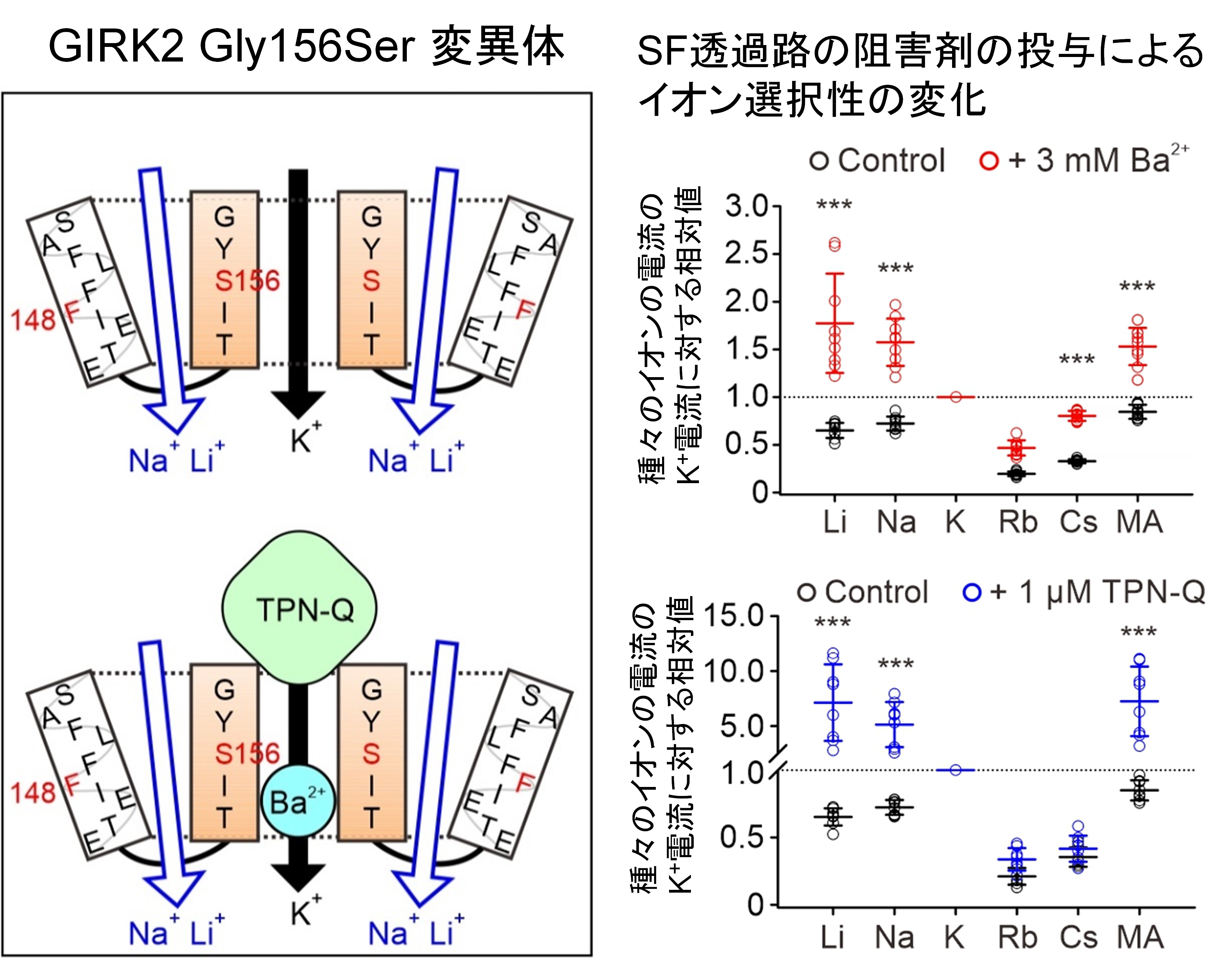
Gly156Serの変異により、通常のSFの構成するK+ 透過路とは異なるイオン選択性を持つ、Na+やLi+ が透過し、Ba2+ やTPN-Qによる阻害が弱い第二のイオン透過路が新たに形成されたことが示されました。(左図)
GIRK2チャネルGly156Ser変異体の種々のイオンの透過による電流を、細胞外液に大きさの異なる様々な1価陽イオンを用いて測定した結果を示します。図では、各イオンのK+電流に対する相対的な電流値をプロットしています。ほぼ K+しか透過しない野生型と異なり、Gly156S変異体では、Na+とLi+ がよく透過することが観察されました(右図黒丸)。また、SFの構築する通常のイオン透過路の阻害剤(Ba2+ やTPN-Q)の投与により、Gly156Ser変異体における、Li+ とNa+ のK+ に対する相対的電流値が顕著に増加することが観察されました(右図、Ba2+ 投与:赤、TPN-Q投与:青)。
図4 GIRK2チャネル Gly156Ser変異体の単一チャネル電流のパッチクランプ法による解析
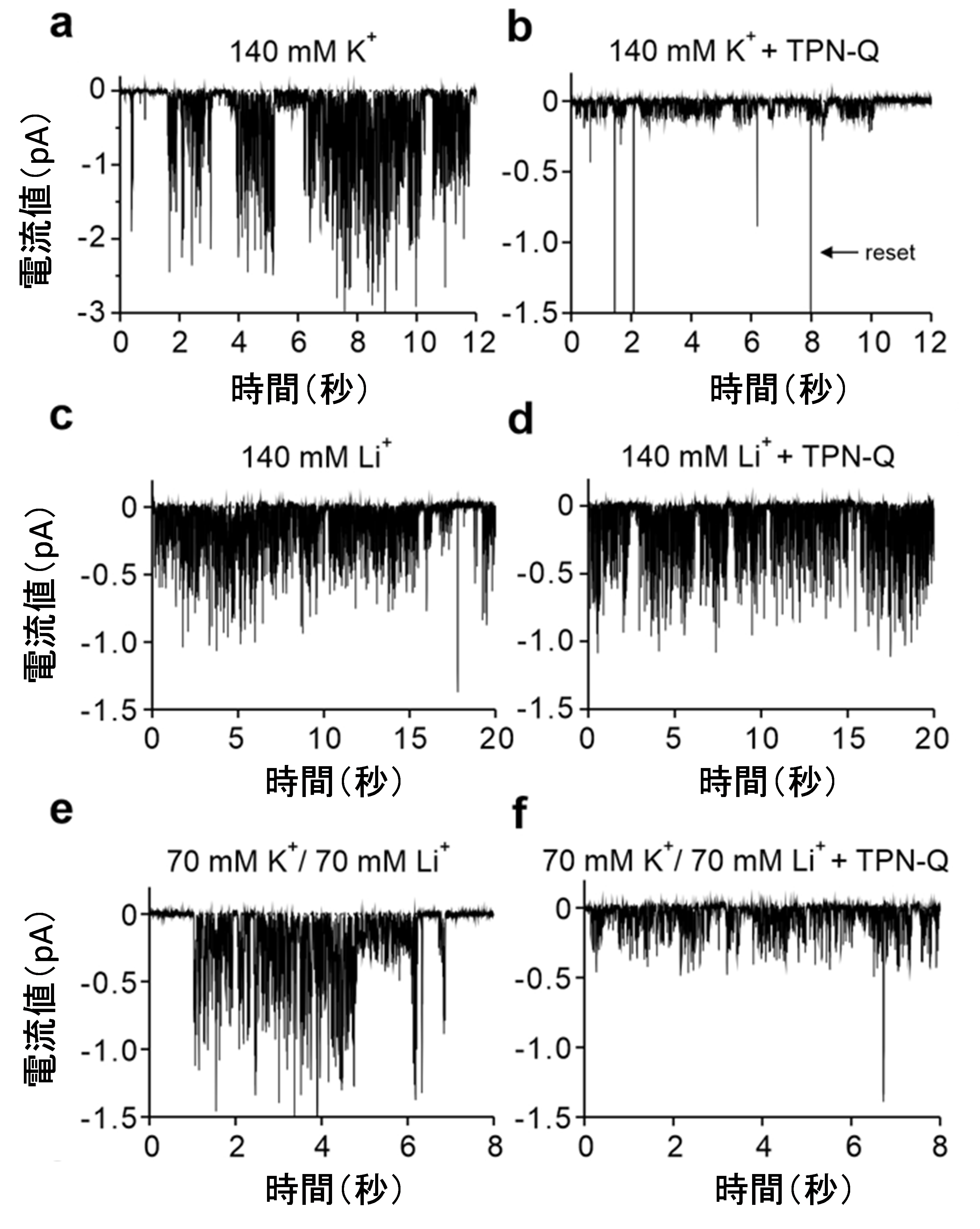
パッチクランプ法による単一GIRK2チャネル分子の電流の測定により、K+電流はTPN-Qにより阻害されること (a, b)、Li+電流は阻害されにくいこと (c, d)、K+とLi+両方を細胞外において記録すると、2種の異なるチャネル活動が記録され、片方のみがTPN-Qにより阻害されること (e, f) が観察されました。これらの結果から、SF透過路とは別の、第二のイオン透過路が変異により形成されていることが示されました。
この研究の社会的意義
これまで、K+チャネルの遺伝子変異による疾患における異常なイオン流入は、イオン選択性フィルタのゆがみ等が原因だと考えられていましたが、今回、第2の透過路の存在が明らかになったことから、この第2の透過路を阻害することにより異常なイオン流入を防ぐ新規治療薬の開発につながることが期待されます。
論文情報
A novel ion conducting route besides the central pore in an inherited mutant of G-protein-gated inwardly rectifying K+ channel
I-Shan Chen, Jodene Eldstrom, David Fedida, and Yoshihiro Kubo
The Journal of Physiology
日本時間2021年 12月9日午前10時 オンライン版解禁
お問い合わせ先
<研究について>
自然科学研究機構 生理学研究所 神経機能素子研究部門
教授 久保義弘 (クボヨシヒロ)
<広報に関すること>
自然科学研究機構 生理学研究所 研究力強化戦略室