安全な細胞運命制御技術の開発に向けて
2019-05-01 東京大学,京都大学,日本医療研究開発機構
発表者
山田 泰広(東京大学医科学研究所 システム疾患モデル研究センター 先進病態モデル研究分野 教授)
山本 拓也(京都大学iPS細胞研究所 未来生命科学開拓部門 准教授)
八木 正樹(ハーバード大学リサーチフェロー/研究当時:東京大学医科学研究所 システム疾患モデル研究センター 先進病態モデル研究分野 助教)
発表のポイント
- 体細胞初期化過程において起こりうるDNAメチル化(注1)異常を同定し、それがインプリント制御領域に起こることを発見した。
- 小児がんにおいても、インプリント制御領域のDNAメチル化異常を同定した。
- 小児がんの発生に体細胞初期化の異常が関与している可能性を示すとともに、異常を起こさない細胞初期化方法を見出した。
発表概要
八木正樹 研究員(ハーバード大学、研究当時:東京大学医科学研究所)、山本拓也 准教授(京都大学iPS細胞研究所)、山田泰広 教授(東京大学医科学研究所 )らの研究グループは、マウスおよびヒトのiPS細胞樹立過程をDNAメチル化に着目して解析し、体細胞初期化過程において特定のインプリント制御領域(注2)にDNAメチル化異常が起こりうることを示しました。さらに、そのDNAメチル化異常を回避する体細胞初期化方法を見出しました。また、小児がんにおいて体細胞初期化に関連するDNAメチル化異常がしばしば観察されることを明らかにしました。これまで体細胞初期化過程におけるゲノムインプリンティング(注3)の安定性の詳細は明らかになっていませんでしたが、本研究ではiPS細胞におけるゲノムインプリンティング異常の詳細を示すとともに、その異常を回避する細胞初期化技術の開発に応用できる可能性を示しました。さらには小児がんの発生に体細胞初期化に起こりうる異常が関与している可能性を示しました。近年、細胞老化を伴う個体の機能低下が様々な疾患の発症に関与していることが明らかになってきました。体細胞初期化により老化細胞の特徴をリセットできることが示され、iPS細胞作製技術は再生医療への応用のみならず、細胞老化の制御にも応用できることが示唆されています。本研究成果は、安全な細胞運命制御技術の開発に貢献することが期待されます。
発表内容
研究背景
体細胞において、CpGアイランド(注4)やインプリント制御領域におけるDNAメチル化状態は、安定的に維持されていることが知られています。体細胞から多能性幹細胞(注5)への初期化過程において、DNAメチル化状態が大きく変化することが分かっていますが、CpGアイランドやインプリント制御領域のDNAメチル化状態がどのように変化するかは不明でした。山田泰広 教授らの研究グループは、マウス胚性幹細胞(注6)において培養条件がインプリント制御領域のDNAメチル化状態に影響を与え、多能性幹細胞の個体発生能の低下を引き起こすことを報告しています(Yagi et al., Nature 2017)。このことから、体細胞初期化過程におけるインプリント制御領域のDNAメチル化状態の安定性を明らかにすることは安全な体細胞初期化技術を開発する上で重要であると考えられます。また、細胞老化を伴う個体の機能低下が様々な疾患の発症に関与していることが明らかになってきました。体細胞初期化により老化細胞の特徴をリセットできることが示され、iPS細胞作製技術は再生医療のみならず、老化細胞を含む細胞の運命制御に応用しうることが示唆されています。安全な体細胞の初期化技術の開発が望まれています。本研究では、体細胞初期化過程でのCpGアイランドやインプリント制御領域におけるDNAメチル化制御の態様の理解を目指しました。
研究結果
1. 体細胞初期化過程の後期で生じうるインプリント制御領域のメチル化異常の同定(図1)
マウス体細胞からナイーブ型(注7)iPS細胞およびプライム型(注8)iEpiS細胞を樹立し、網羅的にDNAメチル化状態を調べました。その結果、CpGアイランドおよびインプリント制御領域の多くは正常なDNAメチル化状態を維持していましたが、一部のインプリント制御領域において正常に比べ高いDNAメチル化レベルを示すことが分かりました。また、これらインプリント制御領域における高メチル化は体細胞初期化の後期で起こることを見出しました。また、ヒトiPS細胞においても同様にインプリント制御領域のメチル化変動が観察されましたが、株間における差も認められました。ヒトiPS細胞におけるインプリント制御領域のメチル化変動はiPS細胞樹立方法やiPS細胞の由来となる体細胞の種類には依存しないことが分かりました。
2. 異常を起こさない細胞初期化方法の開発に成功(図2)
続いて、上述したインプリント制御領域のメチル化異常を回避する手段の探索を行いました。正常なインプリントを有する多能性幹細胞と比較して、体細胞初期化に伴うインプリント制御領域の異常は高メチル化状態として現れることから、メチル基転移酵素(注9)の一つであるDnmt3aの機能に着目しました。Dnmt3aの機能抑制を行い作製したマウスiPS細胞、iEpiS細胞およびヒトiPS細胞は正常なインプリント制御領域のメチル化状態を有することが分かりました。したがって、Dnmt3aの機能阻害は、正常なインプリントを有する多能性幹細胞樹立に有効であると考えられました。
3. 小児がんにおける体細胞初期化と類似したDNAメチル化異常の同定(図3)
がんにおいて、しばしばCpGアイランドやインプリント制御領域のDNAメチル化異常が報告されています。そこで、次に様々ながんにおけるDNAメチル化状態の解析を行いました。その結果、成人がんの多くでは広範なCpGアイランドの高メチル化が認められた一方、小児がんにおいてはCpGアイランドの低メチル化状態は維持されており、しかしながら複数のインプリント制御領域の高メチル化が認められました。このことから、小児がんは成人がんとは異なり、体細胞初期化に関連したDNAメチル化異常と類似した異常を有することが示唆されました。
まとめと展望
本研究では、体細胞からプライム型およびナイーブ型多能性幹細胞への初期化過程において、特定のインプリント制御領域が高メチル化状態になりうることを明らかにしました。また、その変化は初期化過程後期で起こり、Dnmt3aが関与していることを世界で初めて示し、Dnmt3aの機能を阻害することで正常なインプリントを有するiPS細胞の作製に成功しました。また、様々な小児がんにおいて体細胞初期化に関連したDNAメチル化異常が認められたことから、小児がんの発生に体細胞初期化に起こりうる異常が関与している可能性が示されました。ゲノムインプリンティング異常は多能性幹細胞の機能低下を引き起こすことが分かっており、本研究成果は、iPS細胞の品質向上に貢献できる可能性があります。さらに安全な細胞運命制御技術の開発は、個体の機能低下の原因となりうる細胞老化の制御法開発にも貢献することが期待されます。
発表雑誌
- 雑誌名:
- Stem Cell Reports
- 論文タイトル:
- De novo DNA methylation at imprinted loci during reprogramming into naive and primed pluripotency
- 著者:
- Masaki Yagi, Mio Kabata, Tomoyo Ukai, Akito Tanaka, Yui Shimada, Michihiko Sugimoto, Kimi Araki, Keisuke Okita, Knut Woltjen, Konrad Hochedlinger, Takuya Yamamoto*, Yasuhiro Yamada*
用語解説
- (注1)DNAメチル化
- DNAの塩基配列の変化を伴わずに、遺伝子発現を制御する機構をエピジェネティクスという。DNAメチル化はエピジェネティクスの仕組みの代表的な一つで、DNA中の特定配列のシトシンにメチル基が付加されることを指す。
- (注2)インプリント制御領域
- 精子や卵子が作られる過程で、DNAメチル化などのエピジェネティックな修飾を受けてインプリント遺伝子(注3 参照)の発現を制御しているゲノム領域のことを指す。
- (注3)ゲノムインプリンティング
- 遺伝子の多くは父親由来と母親由来の2つの遺伝子(対立遺伝子)を持っている。原則として父親由来、母親由来双方の対立遺伝子がどちらも同じように働く、あるいは働かないよう制御されている。しかし、いくつかの遺伝子は、生殖細胞(精子あるいは卵子)ができる過程で父親由来あるいは母親由来の遺伝子に「しるし」がつけられ(DNAメチル化)、父親由来、母親由来片方からのみ発現を示す(インプリント遺伝子)。そして、この「しるし」は受精卵や子の体細胞に記憶(維持)される。体細胞におけるインプリンティングの維持はほ乳類の発生や恒常性維持に重要であることがわかっている。
- (注4)CpGアイランド
- シトシン(C)の次にグアニン(G)が現れる塩基配列(CpG)の中で特にCpGの出現頻度が他のゲノム配列に比べ高い領域を指す。CpGアイランドはしばしば低いDNAメチル化状態を示し、遺伝子発現制御に重要であることが知られている。
- (注5)多能性幹細胞
- ほぼ無限に増殖することができ、様々な細胞へと分化する能力を有する細胞を指す。代表的な多能性幹細胞として、iPS細胞(人工多能性幹細胞)やES細胞(胚性幹細胞)、iEpiS細胞(エピブラストステムセル)が挙げられる。
- (注6)胚性幹細胞(ES細胞)
- 発生初期段階の初期胚(胚盤胞)から将来胎児になる細胞の集団を取り出し、培養し続けられるようにした細胞を指す。様々な組織や臓器の細胞に分化する能力と ほほ無限に増殖する能力を有する。
- (注7)ナイーブ型
- 着床前の胚(胚盤胞)に類似した性質を有する多能性幹細胞を指す。マウスの場合、受精後3.5日目の胚に相当する。
- (注8)プライム型
- 着床後の胚(エピブラスト)に類似した性質を有する多能性幹細胞を指す。マウスの場合、受精後6.5日目の胚に相当する。
- (注9)メチル基転移酵素
- DNA中の特定配列の炭素原子(主にCpG配列)にメチル化を付加する酵素のことを指し、Dnmt3aやDnmt3bが代表的な新規メチル化酵素の遺伝子として知られている。
添付資料
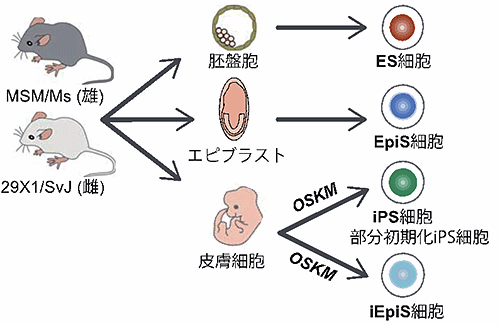
図1:父親由来と母親由来の2つの遺伝子(対立遺伝子)を区別できる多能性幹細胞の樹立
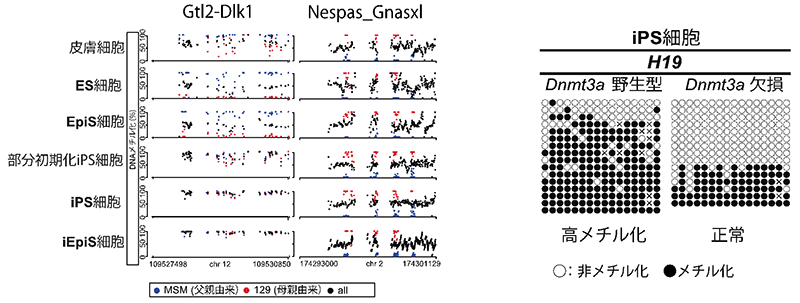
図2:多能性幹細胞におけるインプリント制御領域の高メチル化
多能性幹細胞では、CpGアイランドの中でも特にインプリント制御領域に含まれるCpGアイランドの一部に高メチル化が観察される。インプリント領域Nespa_Gnaslxlは体細胞初期化後も安定的にDNAメチル化が維持されていた一方、別のインプリント領域Gtl2-Dlk1ではiPS/iEpiS細胞において高メチル化が認められた(左図)。 Dnmt3aの機能阻害により、その高メチル化を回避することが可能である(右図)。
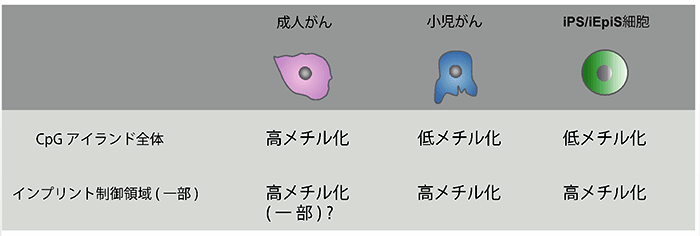
図3:小児がんにおける体細胞初期化に関連したDNAメチル化パターンの異常
本研究への支援
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「全ライフコースを対象とした個体の機能低下機構の解明」研究開発領域における研究開発課題「時空間老化制御マウスを用いた細胞老化が及ぼす個体生命機能の理解」(研究開発代表者:山田泰広)および次世代がん医療創生研究事業(P-CREATE)における研究開発課題「異分野先端技術融合による薬剤抵抗性を標的とした革新的複合治療戦略の開発」(研究開発代表者:山田泰広)の一環で行われました。
お問い合わせ先
本研究に関すること
東京大学 医科学研究所 システム疾患モデル研究センター 先進病態モデル研究分野
教授 山田 泰広(やまだ やすひろ)
京都大学iPS細胞研究所に関すること
京都大学iPS細胞研究所 国際広報室
AMED 事業に関すること
革新的先端研究開発支援事業(AMED-CREST)について
国立研究開発法人 日本医療研究開発機構
基盤研究事業部 研究企画課
次世代がん医療創生研究事業(P-CREATE)について
戦略推進部 がん研究課