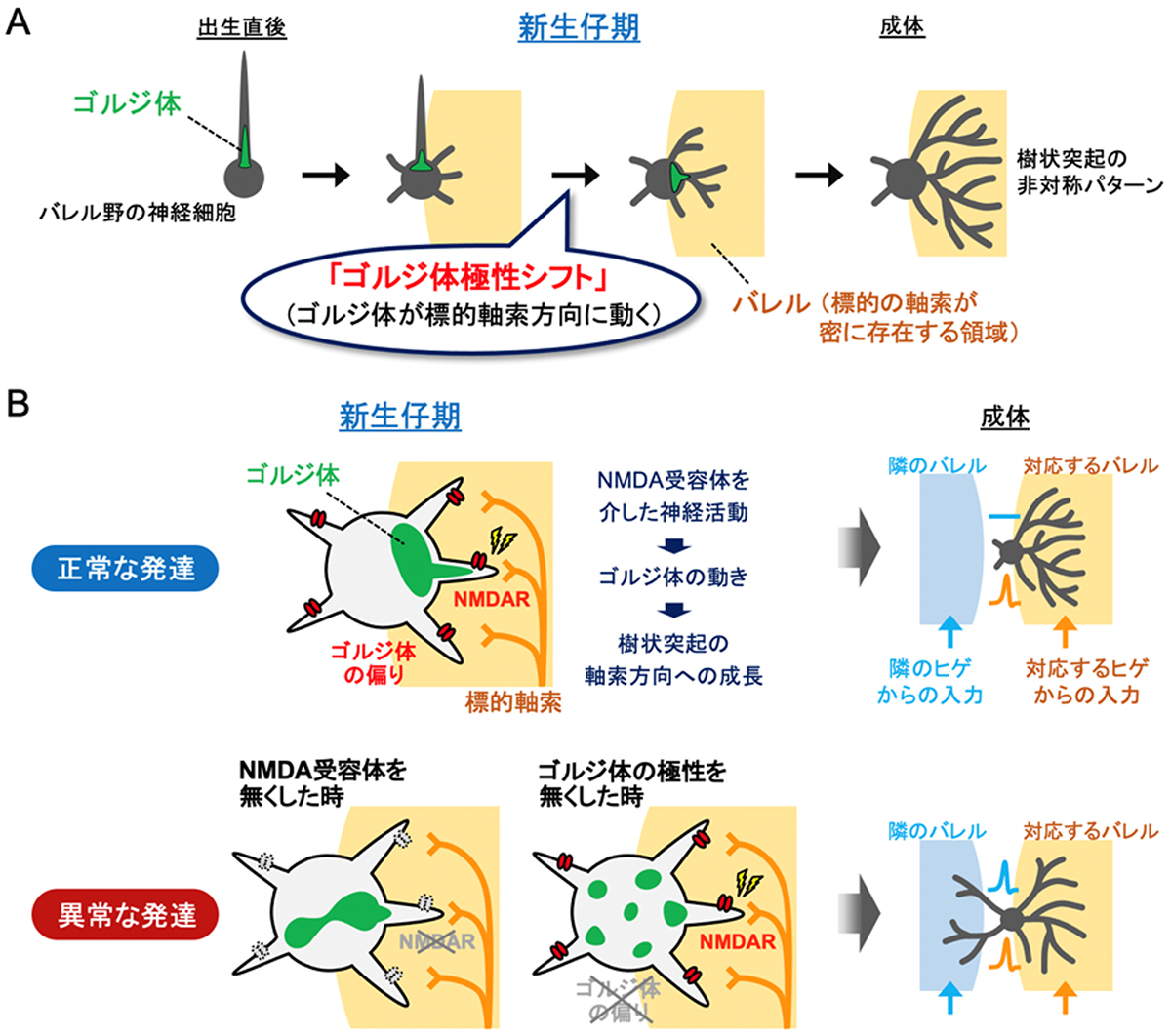
2023-07-31 生理学研究所
自然科学研究機構生命創成探究センター/生理学研究所の村田和義特任教授の研究グループは、同機構分子科学研究所の飯野亮太教授、千葉大学の村田武士教授、東京大学の上野博史講師と共同で、腸球菌が持つ回転式ナトリウムイオンポンプがイオンを輸送する際に示す6つの中間構造すべてをクライオ電子顕微鏡※1を用いて明らかにしました。本イオンポンプでは、これまで金ナノ粒子標識による1分子計測実験から、主となる3つの構造の各あいだにそれぞれ副となる構造が観測され合計6つの中間構造があることが予想されていましたが、その実態は不明でした。また、動力部とポンプ部とをつなぐ細いシャフト(回転子)がこれよりもサイズの大きなナトリウムイオン輸送リングをどのように回転させているのかも謎でした。今回の解析により、(1)回転子は固定子と一部構造的に干渉し合うことで不均一な回転挙動を示すこと、(2)回転子が大きなイオン輸送リングの縁に結合しリングをかき混ぜるように回転させること、がわかりました。
本成果により、回転式ナトリウムポンプのユニークな分子メカニズムが明らかになりました。
本研究成果は、日本時間 2023年 7月28日午後6時に、英国科学雑誌「Communications Biology」にオンライン公開されました。
発表のポイント
・クライオ電子顕微鏡を用いて回転式ナトリウムポンプが示す6つの中間構造をすべて可視化することに成功した。
・以前の1分子計測実験において、回転子の3つの主停止点は120°ずつ離れ、3つの副停止点は主停止点から40°進んだ位置(80°戻った位置)だと予想されていたが、実際は回転子が固定子の一部と干渉することで不均一な回転角度を示していた。
・回転角度のズレは、主に回転子末端のサブユニットdが固定子のサブユニットaと構造的に干渉することによって引き起こされると考えられた。
・動力部とポンプ部とをつなぐ回転子はイオン輸送リングの中心からズレた縁に結合し、大きなサイズのイオン輸送リングをかき混ぜるように回転させていた。
研究の背景
細菌からヒトに至るまでほぼすべての生物は、回転式酵素のATP合成酵素またはイオンポンプをその細胞膜に持っています。これらは共通してATPという化合物を分解または合成するための膜外部分と溶液中のイオンを通過させるための膜内部分とが細いシャフト(回転子“Rotor”)で連結された構造をしており、ATP合成酵素では膜内外におけるイオンの流れのエネルギーを利用してATPを合成し、逆にイオンポンプではATPを分解することで膜の間で特定のイオンを輸送することができます。
腸球菌(Enterococcus hirae)がもつ回転式ナトリウムポンプ(EhV-ATPase)(図1)は、細胞膜外の動力部(V1)でATPを分解してその中心にある回転子を回転させ、これが膜内のポンプ部(Vo)のナトリウム輸送リング(c-ring)を回転させることによって、ナトリウムイオンを細胞内から外に輸送します。動力部は、対称に配置された3つのATP分解ドメイン(A/B)で構成され、これらが順番にATPを分解することで、回転子を120度ずつ回転させることがわかっています。我々の共同研究グループでは以前、この動力部を金ナノ粒子で標識して1分子計測を行い、120°ずつ回転する回転子の主停止点(State1〜3)から40°進んだ位置(主停止点から80°戻った位置)に副停止点が存在し、合計6つの回転停止点からなる中間構造を持つことを見出しました。また、EhV-ATPaseは高等生物のV-ATPaseと同様に大きなc-ringを持っていますが、高等生物で見られるような、回転子をc-ringの中心に真っ直ぐにつなぐ別のタンパク質サブユニットは存在しません。よってEhV-ATPaseでは、(1)副停止点を含む6つの中間構造は実際どのような構造なのか、(2)細い回転子がどのように大きなc-ringを回転させるのか、が謎でした。
研究成果
本研究では、これらの謎に答えるため、界面活性剤で可溶化したEhV-ATPaseにATPとナトリウムイオンを加えて回転を誘導した試料を急速凍結し、クライオ電子顕微鏡を用いて画像を多数収集しました。そして、得られた像を分類して立体再構成し、3つの主停止点に加えて3つの副停止点の合計6つの中間構造を立体再構築することに初めて成功しました(図2A)。
その結果、EhV-ATPaseの回転は、理想的には120°ごとに主停止点(State1〜3)で止まると想定されており、State1とState2ではその理論通りでしたが、State3においては、-10°の回転子の角度のズレがあることがわかりました(図2A)。またその間の副停止点(State1’〜3’)においては、State1’で+13°、State2’で+32°、State3’で+28°の角度のズレが観察されました。そして、回転子はc-ringの中心から外れてリングの縁に結合し、c-ringをかき混ぜるようにして回転させることがわかりました(図2B)。この回転角度のズレはState2~State3’の間で特に大きくなっており、これらは回転子の末端のサブユニットdが、隣接する固定子のサブユニットaと構造的に干渉し合うことによって引き起こされると考えられました(図2C)。
動力部V1では、回転運動中のATPの結合・分解状態の変化を部分的に確認することができました(図3A)。これまでの研究から対称に配置された3つのATP分解ドメインには、ATPが結合した“Closed”、ATPがADPとリン酸(Pi)に分解された“Semi-closed”、ATPが結合していない“Open”の3つの状態が連続的に出現すると考えられています。これらを得られた構造マップに当てはめると、3つの主停止点においては、これに合致したATP分解ドメインの構造を確認することができました。一方、3つの副停止点においては、State2’を除いて、分解産物のADPが外れて“Open”になる前の、すべてのATP分解ドメインが化合物で満たされた状態と考えられる構造が得られました(図3)。State2’では先に述べたように、回転子と固定子が構造的に干渉することにより、ATP分解ドメインが次のState3と同じ状態まで進んで停止すると考えられました(図3B)。
成果の意義および今後の展開
本研究では、EhV-ATPaseの構造変化を積極的に誘導してクライオ電子顕微鏡を用いて解析することで、EhV-ATPaseが示す6つの中間構造(停止点)すべてを可視化することができました。また、EhV-ATPaseでは回転子が大きなサイズのc-ringをかき混ぜるように回転させてナトリウムイオンを輸送することが明らかになっただけでなく、回転子が固定子の一部(サブユニットa)と構造的に干渉することで、部分的に回転角度のズレが引き起こされていることがわかりました。これらのことは、細菌から高等生物にまで広く偏在する回転式イオンポンプが、単純な構造からより複雑な構造に進化を遂げていく上での適応過程を示唆するとともに、阻害剤の開発や酵素の機能改変を行うために基礎となる構造的基盤を多く提供することができました。本成果をもとに、今後、本イオンポンプを対象にした創薬開発が大きく進むことが期待されます。
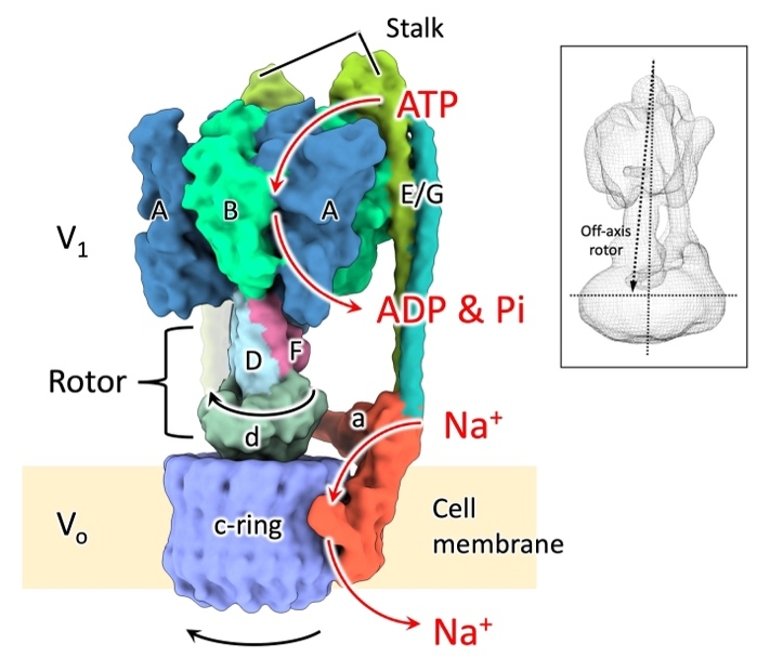
図1 回転式ナトリウムイオンポンプEhV-ATPaseの構造。細胞膜外でATPを分解して中心の回転子(Rotor)サブユニットD/F/dを回転させるV1と、細胞膜内でc-ringを回転させることでナトリウムイオン(Na+)を細胞内から細胞外に輸送するVoからなる。V1は、A, B, D, E, F, G, dの7種類の、Voはa, c (c-ring)の2種類のタンパク質サブユニットで構成される。V1とVoは“Stalk”と呼ばれるサブユニットE/Gでつながり空回りを防いでいる。これまでの研究で、回転子が傾いてc-ringと結合することがわかっていた(挿入図)が、どのようにして回転子がc-ringを回転させるかは謎であった。
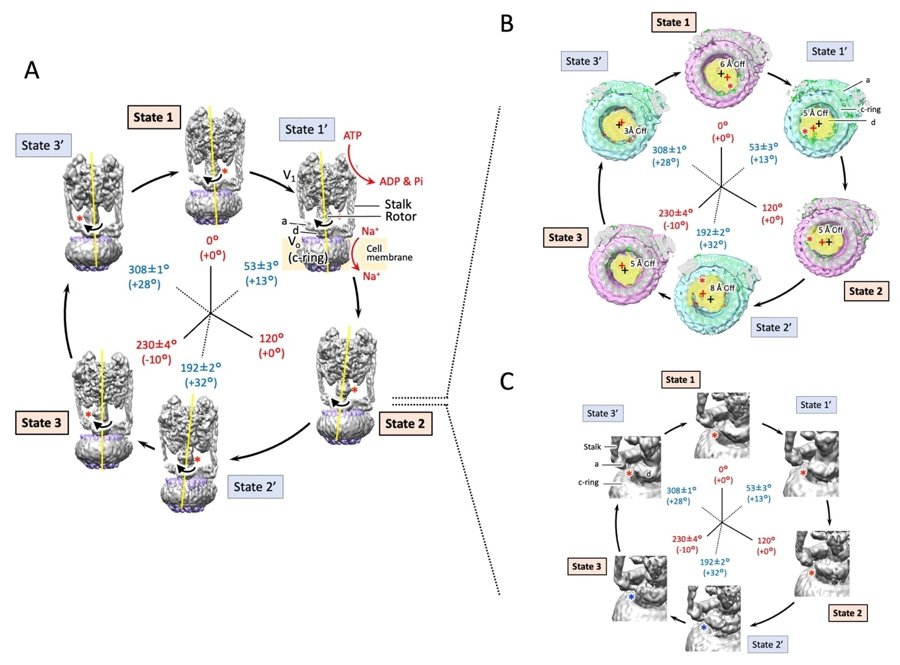
図2 EhV-ATPaseが示す6つの構造変化。State1〜3は主停止点、State1’~3’は副停止点を示す。主停止点は回転子が120°ずつ回転した構造であるが、State3では-10°角度がズレていた。また、副停止点ではState1’では+13°、State2’では+32°、State3’では+28°ズレていた。(A)EhV-ATPaseの全体構造。(B)回転子末端のサブユニットdとc-ringとの位置関係。サブユニットd(赤の“+”は重心位置を示す)はc-ringの中心(黒の“+”)から離れた位置でc-ringと接している。結果、(A)の黄色の線で示すように回転子はc-ringをかき混ぜるように回転させる。(C)回転子末端のサブユニットdと固定子のサブユニットaとが構造的に干渉する様子。
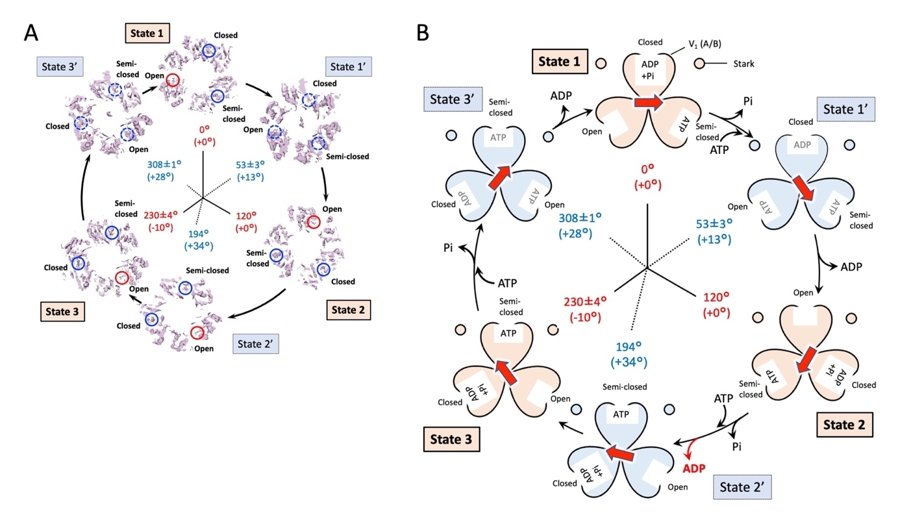
図3 EhV-ATPaseの6つの中間構造におけるV1のATP分解ドメインの構造変化(A)およびATP分解反応と回転子の回転運動の関係の模式図(B)。
研究サポート
本研究は、科学研究費補助金(JP16H06280, JP22H04926, JP19H05380, JP18H05425, JP18H05424)、生理学研究所一般共同研究(16-038)、生理学研究所若手研究者支援、AMED BINDS(JP17am0101001, JP22ama121005j0001)等の支援を受けて行われました。
掲載論文
雑誌名:Communications Biology
論文タイトル:Six states of Enterococcus hirae V-type ATPase reveals non-uniform rotor rotation during turnover
著者: Raymond N. Burton Smith, Chihong Song, Hiroshi Ueno, Takeshi Murata, Ryota Iino, Kazuyoshi Murata*
(*責任著者)
掲載日:日本時間2023年 7月28日午後6時
DOI: 10.1038/s42003-023-05110-8
発表者
Raymond N. Burton-Smith、 Chihong Song、 村田 和義(生命創成探究センター/生理学研究所)、上野 博史(東京大学)、村田 武士(千葉大学)、飯野 亮太(分子科学研究所)
用語解説
※1:クライオ電子顕微鏡
生物試料を低温(約-170℃)で観察することができる電子顕微鏡。生物試料を水溶液環境中で凍結させて、そのまま観察することができる。
本研究に関するお問い合わせ先
研究全般に関するお問い合わせ先
自然科学研究機構 生命創成探究センター/生理学研究所
特任教授 村田 和義
報道に関するお問い合わせ先
自然科学研究機構 生命創成探究センター 研究戦略室
自然科学研究機構 生理学研究所 研究力強化戦略室
自然科学研究機構 分子科学研究所 研究力強化戦略室 広報担当
東京大学 大学院工学系研究科 広報室
千葉大学 企画部渉外企画課広報室